Máximo Sandín
Lo que sigue a continuación es un trabajo teórico de un alumno de 2º Curso de Biología de la Universidad Autónoma de Madrid.
El motivo de esta presentación no es avalar el interés científico del texto (que se avala por sí mismo), sino situarlo en su contexto. Se trata de un trabajo, que los alumnos de una asignatura sobre evolución que imparto en nuestra Universidad, deben realizar como sistema de evaluación. Es uno más entre otros muchos de una gran calidad, que espero que puedan ser publicados (o, al menos, difundidos, gracias a la bendita Internet) a la mayor brevedad posible.
Resulta muy gratificante comprobar hasta qué punto una mente joven, trabajando libre del lastre dogmático y rutinario de las interpretaciones convencionales de la “vieja Biología” (hay que decir: laboriosamente “desprogramada” a lo largo de un curso), puede mostrar una clarividencia que sería muy deseable en las autoridades científicas involucradas en problemas de tal trascendencia científica y social como el que en este trabajo se trata.
Es precisamente esta trascendencia la que justifica la urgencia de darle la máxima difusión, porque la obcecada concepción de los fenómenos de la Naturaleza como una perpetua lucha sin cuartel en la que es necesario exterminar a los terribles patógenos (bacterias, virus, ahora priones…) que esperan agazapados esperando su oportunidad para invadirnos (pero, cual astuto experto en “ingeniería económica”, sin destruirnos del todo, para no quedarse sin quién explotar), hace imposible comprender el verdadero origen del problema, es decir: por qué unos elementos fundamentales en el funcionamiento de los procesos que componen la vida se convierten en patógenos.
Espero que este trabajo científico resulte esclarecedor para personas relacionadas (o afectadas) por su profesión con el llamado “mal de las vacas locas”. Quizás les ofrezca una pista sobre lo que no hay que hacer, además de no alimentar a herbívoros de una forma aberrante. Porque lo que resulta absurdo es tener que emplear una gran cantidad de medios humanos y económicos en luchar (con escasa fortuna) contra un supuesto enemigo que hemos creado previamente.
Mis experiencias me han llevado a la pérdida de la esperanza en que trabajos como este, inteligentes, bien documentados e impecablemente argumentados desde el punto de vista científico, hagan recapacitar a los rígidos (y, en ocasiones, hasta agresivos) “guardianes de la ortodoxia” sobre la necesidad, cada día más urgente, de replantearse desde sus cimientos la base teórica de la “vieja Biología”. Porque la impresión que producen es de que, posiblemente, el paso de los años asumiendo y repitiendo los mismos tópicos, les haya convertido en “no desprogramables”. Tal vez tuviera razón Max Plank cuando afirmaba que sólo la muerte de los sustentadores de una visión científica caduca hace posible que otra nueva se abra paso (lo cual es un triste consuelo, porque me encuentro demasiado cercano a las promociones de los susodichos), pero en cualquier caso trabajos como este (y muchos otros más) de jóvenes científicos, son la mejor prueba de que “la nueva Biología” ha iniciado su camino, y ni la rutina, ni la soberbia, ni los oscuros intereses económicos que están detrás de la vieja concepción, podrán detenerla.
LOS PRIONES EN LA EVOLUCIÓN
Salvador Cenador Herrera
2º Curso Licenciatura de Biología. Universidad Autónoma de Madrid.
INDICE
:: 1. Introducción ………………………………………………………… 2
:: 2. Lo que ahora sabemos de los priones ……………………….. 4
:: 3. Reinterpretando los priones …………………………………….. 6
:: 4. El origen de las EET’s ……………………………………………. 8
:: 5. El papel de los priones en la Evolución …………………….. 11
:: Bibliografía ……………………………………………………………….14
Vivimos un momento en la historia de la Biología en la que por fin parece que empezamos a darnos cuenta de lo falso y subjetivo que es el pilar sobre el que se sustenta toda nuestra ciencia. Hemos estado creyendo en un imposible tan solo porque es la única realidad que se nos ha mostrado pero también porque no hemos querido mirar más allá. El darwinismo ha contaminado el lenguaje que usamos utilizando términos que denotan unas características tan sólo aplicables a nuestra sociedad: hablamos de represores que compiten por el centro activo de una enzima, de que cada célula de un ser multicelular intenta egoístamente proliferar más que las demás pero estas otras la contienen, de plegamientos de proteínas que son seleccionados por ser más aptos…
Pero sobre todo hablamos de la competencia entre seres vivos por ocupar un nicho ecológico, del egoísmo de cada individuo que mira por sí mismo. Decimos que el responsable de los cambios que sufren los organismos y que los hace evolucionar es la Selección Natural, un “ente” que cada darwinista parece interpretar de una forma y en el que todo cabe, una fuerza ciega que elige a aquellos individuos más aptos. Y la fuente de nuevas características resultan ser mutaciones en el ADN al azar, de forma que los individuos que tengan una nueva característica beneficiosa serán seleccionados. Y todavía más: estos pequeños cambios hacen que gradualmente las especies diverjan, cambien y se adapten a su medio.
En definitiva dicen que la Evolución son cambios en las frecuencias con las que aparecen genes en una población.
Y los datos dicen justo lo contrario. Por un lado la idea de que las mutaciones al azar son fuente de variabilidad para la Selección Natural es completamente absurda pues una mutación puntual lo único que causa es, en el “mejor” de los casos, un fallo de funcionamiento de una proteína pues aún no se ha catalogado ninguna mutación beneficiosa en ningún organismo y si incontables casos de mutaciones inducidas que han causado el deterioro de las capacidades del individuo ¿cómo puede un fallo en una proteína perfectamente preparada para su función hacerla mejor?. Los grandes cambios que se dan los organismos se deben no a alteraciones de proteínas sino a remodelaciones del programa de desarrollo embrionario. Son innumerables las pruebas en contra del gradualismo de la evolución pero la mas clara es la absoluta falta en el registro fósil de especies intermedias. A la hora de la verdad, no son los individuos ni más ni menos aptos los que sobreviven sino que quedan los intermedios… No enumero más datos por no ser éste el objetivo de la presente introducción. La Evolución por selección natural es una explicación falta de pruebas sólidas, que tiene grandísimas dificultades para explicar comportamientos de cooperación y altruismo entre otros y que sobre todo está sesgada por la visión de la vida que tienen sus creadores.
Pero es que aunque el darwinismo aceptara: los cambios bruscos, la complejidad necesaria para explicar la realidad de los procesos biológicos, la imposibilidad del azar como motor de cambio… aun reduciendo la teoría a su mínima esencia, la de que solo sobrevive el más apto por competencia con sus rivales, sea cual sea la definición de “más apto” y su origen, toda la “teoría” se convierte en una opinión personal, en una forma de querer ver a la vida funcionando al igual que la sociedad occidental en la que priman precisamente (aunque no generalizadamente por suerte) ese egoísmo, ese mirar por el bien de uno mismo “que en conjunto hace el bien común”, esa competencia por llegar más alto, ese ver el altruismo como un egoísmo camuflado… Hemos otorgado a la naturaleza rasgos y etiquetas puramente culturales y que ni siquiera están generalizadas al conjunto de civilizaciones humanas ni de individuos.
Pero incluso esta ya “opción personal” se queda sin fundamentos al ver cómo en realidad. En los seres vivos prima la cooperación como desencadenante de los grandes cambios que se han producido a lo largo de la historia como es la endosimbiosis, la multicelularidad, el agrupamiento de individuos de la misma especie e incluso de diversas especies, la integración de genomas de diferentes orígenes a través de vectores…
Hemos creado una biología basada en la subjetividad y en la explicación de la realidad por modelos simplistas y estamos pagando este error caro viendo como los datos quedan inconexos e incluso perdiéndose y olvidándose al no entender cómo encajarlos. Lo pagaremos todavía más caro cuando veamos las desastrosas consecuencias de, por ejemplo, la terapia genética, por haber querido simplificar la expresión del DNA introduciendo genes en lugares al azar.
Y esta forma de querer simplificar las cosas ha llegado hasta un campo tan aparentemente inconexo con la evolución como son los priones. De ellos no parece interesar más que cómo son y las enfermedades que causan (las EETs: Encefalopatías Espongiformes Transmisibles). Se sabe que cuando el prión encuentra una versión de sí mismo (pero no patógena) la “prioniza” y con eso y poco más basta, porque lo único que interesa es la forma de neutralizarlos. No parece que nadie se haya preguntado cómo han aparecido y cómo es posible que una simple proteína pueda replicarse.
Desde que se intensificaran las investigaciones hace 8 años tras la primera muerte de un hombre por el mal de las vacas locas, se ha producido una avalancha incontenible de datos incomprensibles e incomprendidos que está empezando a hacer ver a algunos investigadores que el modus operandi no es tan simple y que tal vez estas proteínas cumplan un determinado papel en los organismos. Y es que a la hora de la verdad, preciosos conocimientos y datos son malgastados con extrañas y a la vez artificiales interpretaciones. Un ejemplo de lo que digo es un reciente trabajo (Deleault y cols., 2003) que habla sobre cómo el ARN de la célula cataliza la conversión de proteínas a priones: en él los investigadores se quedan simplemente con un “este descubrimiento podría servir para diagnosticar EETs” sin darse cuenta de lo mas obvio que tienen delante y es que esto significa que la célula afectada participa activamente en su propia infección con todas las consecuencias que ello conlleva.
¿ Y que tienen que ver los priones con la evolución? Pues de entrada se ha visto que transmiten caracteres heredables como ya veremos mas adelante, por lo que resultan un nuevo campo de estudio para la evolución que ya no queda restringida a los genes. No adelanto más por ahora.
A lo largo del trabajo voy a proponer una serie de modelos e ideas de las que, aunque he argumentado su razón de ser con datos, de primeras acepto pueden ser falsas, erróneas o incompletas. No es mi intención ni mucho menos proponer un nueva Teoría Priónica alternativa a la que ya existe, pues la bibliografía que he usado no se puede comparar a la de un experto en la materia. Con los modelos lo único que persigo es hacer ver que la situación no es tan sencilla, que hay que empezar a ver a estas proteínas con otra óptica y sobre todo que hay que quitarse de la cabeza esa idea obcecada de que (al igual que se piensa de los virus) no son mas que patógenos indeseables.
El encontrar la naturaleza de la partícula que causaba el scrapie y el kuru entre otras encefalopatías espongiformes supuso un auténtico quebradero de cabeza para los bioquímicos. No se encontró ningún virus ni bacteria implicados directamente y puesto que la partícula causante resistía tratamientos que destruían ácidos nucleicos, se descartó la posibilidad de que éstos fueran los responsables. Stanley Prusiner en 1982, tras comprobar como medios proteolíticos inactivaban al causante, propuso que el agente era nada menos que una proteína patógena a la que denominó “prión”.
La Teoría Priónica actual propone que el prión (PrPsc) es una proteína idéntica en su secuencia de aminoácidos a una proteína sintetizada por el propio organismo afectado (PrPc) pero diferente en su conformación (forma que adopta en el espacio).La infección es debida a que la presencia de la variante patógena induce a las del organismo a plegarse adoptando la forma de la PrPsc. Éstas a su vez, inducen el cambio a las otras PrPc transmitiéndose la infección en cascada. Pese a la gran cantidad de nuevos datos, en nada ha cambiado la concepción de que el prión ejecuta este proceso por sí mismo y de que sólo están implicadas estas proteínas.
Debido al fuerte impacto social causado por la aparición de los primeros casos de transmisión a humanos de la enfermedad de las vacas locas, se han destinado ingentes cantidades de fondos para la investigación de la naturaleza química del prión, de la forma en que actúa dentro del organismo y sobre todo de fármacos eficientes para luchar contra él. Los análisis bioquímicos han desvelado que la PrP es una proteína globular de 253 aminoácidos, que a razón de 50-100 aa por dominio la convierten, en mi opinión, en una proteína demasiado pequeña para querérsele atribuir todas las actividades que veremos que hace “por su propia cuenta”. De su estructura espacial, tan solo se ha secuenciado y representado por cristalografía el gran dominio que comprende los restos 129-225 el cual parece ser el que diferencia a la versión “Dr. Jekyll” de la “Hyde”.
Pese a la gran cantidad de experimentos aún no se ha descubierto la estructura del resto de la proteína. Una lástima, pues la actividad realmente interesante del prión se encuentra precisamente en ese sector que al parecer interactúa asombrosamente con secuencias concretas de DNA (volveremos más tarde a este dato). Sí se sabe que tiene una secuencia de reconocimiento en los 23 primeros aminoácidos y que entre medias posee una zona afín a iones de Cu: un inusual motivo de 8 aa repetido 4 veces del que no se sabe la razón de su emplazamiento en el prión (www.chemsoc.org).
Respecto al tratamiento de las EET’s (Encefalopatías Espongiformes Transmisibles) no se ha encontrado ni una sola sustancia capaz de neutralizar priones, ni siquiera de frenar su avance: algo completamente decepcionante dado los recursos destinados al respecto. Pero es que además tampoco el sistema inmunitario responde a la infección. De la escasa colección de sustancias que han sido capaces de mostrar algún resultado, se ha encontrado una molécula que debería habernos hecho plantearnos muchas cosas: la adamantina, un antirretroviral (repito: antirretroviral) que en algunos casos ha sido capaz ralentizar el avance de la enfermedad. ¿No debería haber indicado esto que entonces los retrovirus participan en el proceso acelerándolo?.
No sólo este dato lo confirma. Científicos como Laura Manuelidis o C. Weissmann (2003) han insistido siempre en que la proteína no puede ser el único componente del prión proponiendo la necesaria existencia de un virus o ácido nucleico asociado. Aunque sus propuestas se han desechado tras comprobar que la proteína per se era capaz de llevar a cabo la infección, lo cierto es que en las últimas investigaciones se ha demostrado en los cerebros de los infectados la presencia de un retrovirus con un genoma de entre 1 y 3 kilopares de bases. Es más, los estudios llevados a cabo por Carp parecen indicar que la replicación del MuLV en ratones acelera el avance de la enfermedad del scrapie. La cosa va en serio y se están iniciando grandes programas de investigación para aclarar esta relación como uno del GSF junto con el Institut für molekulare Virologie del que ya adelantan la hipótesis de que “los priones activan retrovirus endógenos o exógenos latentes”
Otro aspecto en el que se ha avanzado ampliamente es en el de las acciones que desempeña el prión patógeno en el organismo aunque resulta paradójico que aún no esté claro que hace la versión celular dentro del organismo. Por un lado se especula con que regularía el Cobre dentro de las neuronas actuando de receptor de membrana, por otro se habla de actividad catalítica (superóxido dismutasa) y otros han propuesto algo realmente interesante al analizar su actividad: que debe participar en vías de señalización celulares.
Por el contrario, como hemos dicho, ahora conocemos parte de la actividad de la PrPsc. De entrada al contactar con la membrana celular es reconocida por receptores asociados a la versión celular del prión, siendo asimilada por la célula mediante vesículas recubiertas de Clatrina (un mecanismo frecuente usado por la célula para absorber ciertas sustancias). Ni que decir tiene que los receptores son específicos para cada sustancia y por tanto la célula “espera” a esa sustancia para recogerla. Una vez dentro de la célula empieza la reacción en cascada creando copias de sí misma al cambiar la conformación de sus semejantes celulares, para lo cual DEBE evadir la acción de las chaperonas (proteínas encargadas de corregir cualquier cambio erróneo en la conformación de las proteínas a su cargo, algo para lo que son extremadamente eficientes).
Pero no sólo eso: los priones son capaces de llegar al núcleo celular debiendo atravesar para ello los poros celulares que admiten exclusivamente un reducido grupo de moléculas. Una vez allí, tienen el poder de replegar determinadas secuencias de DNA y hacer saltar retrotransposones y retrovirus haciendo de promotor para esta acción (C. Gabus y cols. 2003).
¿ Cómo va a poder una proteína tan pequeña: ser reconocida por receptores de membrana, cambiar la conformación de otras proteínas, engañar a las chaperonas, atravesar el poro nuclear, asociarse al ADN y hacer saltar elementos genéticos por sí misma? Es sencillamente imposible que un “parásito” tan pequeño haga todo eso. Es prácticamente de cajón que la célula está colaborando en el proceso de principio a fin, le pone al prión todas las facilidades para desempeñar su acción. Casi con seguridad la proteína no debe poder ni siquiera hacer nada por sí misma, sino que el organismo al reconocer al prión desencadena todas las acciones y seguramente por eso se haya visto al prión participar en las vías de señalización.
Y es que esa colaboración llega hasta el punto de que RNA’s de la misma célula catalizan la reacción PrPc à PrPsc como ya dijimos en la introducción, ayudando además en el plegamiento factores como las Proteínas X, Y y Z (encontradas pero aún no descritas).
¿ Y por qué el huésped iba a participar en su propia destrucción? Con toda seguridad porque el prión, esa molécula capaz de cambiar su conformación y desencadenar el cambio en todas las demás, en condiciones normales cumple un cometido dentro del organismo y por tanto no tendría sentido que el organismo se opusiera a ello. Más adelante profundizaremos en cuál es ese papel desempeñado.
Por último, la PrP ha dejado de ser el único prión conocido. Por lo menos ya se han catalogado otras 3 proteínas que con una determinada conformación son capaces de obligar a asumir dicha forma a las restantes: El Het-S del hongo Podospora anserina, la URE3 de levaduras implicada directamente en la regulación del Nitrógeno y la PSI también de levaduras que interviene en la traducción proteica. Lo realmente interesante de estos nuevos priones ha sido ver como todos ellos comparten un dominio proteico muy similar que les confiere el poder alternar conformaciones. De hecho, el equipo de Susan L. Lindquist (2000) ha logrado crear priones artificiales totalmente funcionales a partir de proteínas normales al añadirles el dominio-prión de la PSI.
Como se ve, ni siquiera es un mecanismo exclusivo de mamíferos. Las proteínas-prión se encuentran presentes en grupos dispersos de seres vivos y me aventuro a pensar que tal vez estén presentes todos ellos. Si a esto le sumamos el que todos los priones comparten una estructura similar, deberíamos empezar a pensar que tal vez estén formando parte de un importante mecanismo generalizable a una gran cantidad de proteínas.
Como hemos visto, existen demasiados datos como para seguir pensando que el mecanismo de propagación de un prión sea tan sencillo como se piensa. No es mi intención decir tajantemente cómo funcionan, pero por lo menos quiero proponer un modelo que, aunque con seguridad sea incorrecto o incompleto, al menos sirva para entender la complejidad de la situación y para más tarde mostrar el importantísimo papel que podrían tener en la adaptación (e incluso evolución) de los organismos. Recopilemos los datos que hemos extraído hasta el momento:
Ø Los retrovirus (con toda seguridad endógenos) y retrotransposones saltan del genoma del individuo colaborando de alguna forma en el proceso infectivo del prión.
Ø El organismo “infectado” participa en todo el proceso permitiendo al prión llevar a cabo su tarea pues cumple un cometido dentro de la célula.
Ø Los priones están muy extendidos en la naturaleza existiendo dominios comunes en todos los conocidos convirtiéndolos en un fenómeno generalizado.
El modelo que propongo parte de la idea de que los priones forman parte de un gran mecanismo que permite a estas proteínas alternar conformaciones teniendo cada una de ellas una función diferente. Esto permite al organismo adaptarse a una nueva situación alterando a todas las proteínas del mismo tipo dentro de la vida del individuo con la posibilidad de transmitirle a la descendencia esa nueva característica. ¿Qué es lo que me hace pensar esto? Por un lado creo que es la única explicación razonable a que la célula permita e incite el que se le cambien todas sus proteínas del mismo tipo. Lejos de la simple especulación, en el caso de la URE3 las dos conformaciones participan en la regulación de la asimilación de Nitrógeno: una de ellas permitiéndola y otra reprimiéndola. Concretamente, la forma alterada aparece cuando hay una sobreexpresión de la no alterada siendo la que reprime la asimilación, de forma que (según pienso) la levadura puede evitar un exceso de absorción haciendo aparecer la forma alterada que “secuestra” un buen número de copias de la que incita la asimilación. De no ser así ¿qué razón tendrían los organismos para crear moléculas que alteran la actividad de las demás copias?.
Se trata de un mecanismo para actualizar todas las proteínas del individuo. Ante un cambio brusco ambiental, la célula “busca” en el pool de conformaciones de su proteína-prión cuál es la que mejor funciona en la nueva situación y pone en marcha la maquinaria molecular necesaria para por un lado adaptar a algunas proteínas a la nueva situación y por otro autorizar el cambio en cascada de todas las demás. Es importante destacar la palabra autorizar: sólo si la célula lo permite se inicia el procedimiento, pues de lo contrario si una PrP cambiara espontáneamente a la forma patógena debido a un simple choque térmico o energético (algo que ocurre frecuentemente) poblaciones enteras serían aniquiladas asiduamente.
Sin embargo en un organismo multicelular puede ocurrir que no todas sus células se hayan “enterado” del cambio, bien porque no están en contacto con el estímulo, bien porque sus mecanismos que inician la transformación no han estado en contacto con él. De aquí surge la necesidad de que la célula que ha cambiado le comunique a las de su entorno cuál ha sido la solución que ha encontrado al problema, de forma que por un lado les “manda” copias de su nueva proteína para que la copien, y por otro virus que portan la información necesaria para que la célula receptora se convierta en un nodo de la transmisión del cambio para asegurarse de que llega con rapidez a todo el organismo. Esta fase viral solo aparecería en una frecuencia baja de células que serían productores activos de la forma alterada que cerciorarían el éxito de la transmisión. No es estrictamente necesario que todas las células reciban el retrovirus pues la llegada del prión a una célula ya es suficiente que para que ésta inicie la actualización.
El cambio dentro de la célula que inicia este reajuste debe ser también a escala genética, pues si crea un virus que se envía a otras células es porque ésta tiene una nueva información que no poseen las demás. El prión al interactuar con retrotransposones específicos los debe hacer saltar a las secuencias de la maquinaria que regula este proceso, activando los mecanismos (alternativos a los que ya tenía) que favorecen a la nueva variante del prión. Junto a esto expresa un retrovirus que arrastra los genes de esta nueva maquinaria (chaperonas, proteínas de reconocimiento adecuadas…).
Así, tenemos dos rutas paralelas y simultáneas para la transmisión: una priónica que llega a todas las células y otra viral que llega a unas pocas encargadas de servir de nuevos centros de emisión y que aseguren la permanencia del cambio.
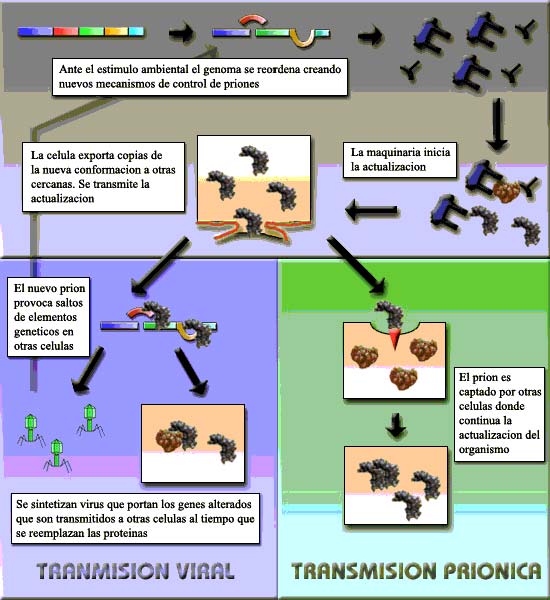
Hemos tratado el mecanismo general basándonos en el ejemplo de la PrP de la que sabemos que la presencia del prión es suficiente para iniciar el cambio. Pero puede que ni siquiera los priones transmitan el cambio a otras células y de ello se encarguen lo virus pues en este caso la forma alterada polimeriza extracelularmente pero ¿y en una proteína que no sale de la célula?. En una situación así el retrovirus debería ser la única forma de transmisión.
Por cierto, es posible que el prión humano no sea la única proteína que se vea afectada en el proceso. En punciones lumbares en reses para la extracción de líquido cefalorraquídeo se ha observado la presencia de proteínas anormales diferentes de la PrP que solo han aparecido en individuos afectados por una ETT.
Algo que nos podría dar en qué pensar es: si una nueva forma inicia el procedimiento de actualización, ¿por qué la forma original no lo comienza también en sentido opuesto contrarrestando el cambio? Con seguridad se debe a que los mecanismos, una vez han aceptado una actualización, bloquean cualquier intento por parte de la conformación original o de una nueva alternativa de hacer lo mismo. Esto que digo queda bastante patente si se analizan los experimentos de Laura Manuelidis y Zhi Yun Lu (publicados en Febrero del 2003) sobre las cepas de priones.
Al parecer, dentro del propio prión de la CJ existen varias cepas con diferentes efectos en el organismo y con conformaciones desiguales. En sus experimentos pudieron comprobar como una vez inoculada una cepa, si se pretendía inocular otra, ésta no tenía ningún efecto actuando en el cerebro solo la primera que fue introducida. Sin embargo, la segunda no fue completamente eliminada, sino que quedó latente en los cerebros de ratones: “La forma virulenta FU (la segunda) puede permanecer en estado latente por largos periodos hasta que otro estrés fisiológico le haga recrudecerse”.
Así, el organismo una vez se ha decantado por un reajuste concreto no permite que otra alternativa prospere, pero en vez de neutralizarla, la “guarda” en espera de que pueda ser utilizada más adelante. En cierta forma es posible que cada célula guarde un acervo de alternativas incorporando las nuevas que le proponen sus vecinas.
Resumiendo, el mecanismo priónico es un procedimiento cuyo fin es actualizar y renovar las funciones del organismo con el fin de adecuarlo a una nueva situación ambiental, que afecta a más proteínas que la del prión y que es “inteligente” (un azar controlado): acepta aquella propuesta que le es útil y si le llega otra no la destruye sino que la almacena. Además, de igual forma que se inicia, si las condiciones vuelven a ser las anteriores el organismo tiene la opción de revertir el proceso (algo que ya comprobó Susan Lindquist con su prión artificial).
Después de ver como el funcionamiento de los priones es un mecanismo perfectamente coordinado y controlado por el organismo, resulta lógico preguntarse cómo y por qué han podido surgir las enfermedades de origen priónico llamadas en conjunto EET’s. En realidad su aparición es un fenómeno más frecuente en la naturaleza de lo que pensábamos: junto al conocido “mal de las vacas locas”, la enfermedad de Creutzfeld-Jakob, el scrapie y el kuru se han catalogado otras afecciones como la enfermedad del agotamiento crónico de mulas y ciervos en cautiverio, múltiples síndromes similares al CJ en humanos y otras variantes en antílopes, felinos y visones. De hecho hasta se ha encontrado la PrPsc en animales tan distantes de los mamíferos como son los peces.
Las Encfalopatías Espongiformes son debidas a que la conformación PrPsc de la proteína del prión humano pierde su función original y precipita formando con otras semejantes largos filamentos que destruyen las neuronas.
A excepción de la bovina, no se ha intentado dar explicación a la aparición de estas encefalopatías. En general se ha aceptado que tiene su origen en el consumo por parte de las vacas de piensos hechos a partir de ovejas contaminadas de scrapie. Aunque la normativa impone que para la elaboración de éstos se debe tratar la carne a 133º durante 20 minutos, el encarecimiento de los combustibles en los años 80 hizo que para ahorrar costes se descuidara el proceso calentando solo hasta 120º, temperatura a la que los priones no son desactivados. Fue entonces cuando saltaron la barrera de la especie detectándose el primer caso de “vaca loca” en 1987. Aunque sea una explicación plausible, se aleja mucho de ser la única observando los datos que hoy tenemos.
Ya de entrada, en 1966 existía un informe en el que se daba a conocer la enfermedad y la posibilidad de su transmisión a nuestra especie (extraído de: Brock. Biología de los Microorganismos) con lo cual se ve que no era una enfermedad precisamente nueva). A raíz del primer contagio en humanos que acabó con la muerte de un joven de 18 años en Inglaterra en 1996 y ante la psicosis mediática resultante, las autoridades sanitarias de todo el mundo prohibieron la elaboración de harinas alimentarias a base de ovejas que más tarde se ampliaría a la de otros muchos animales. Aunque el número de vacas afectadas ascendía a cifras más que alarmantes se esperaba que el mal se erradicara en 5 años (pues los síntomas pueden manifestarse 5 años después del contagio) y que las vacas nacidas de otras sanas tras la medida no presentaran la afección. Sin embargo no han parado de aparecer nuevos casos todos los años, las nacidas en el 97 (y años posteriores) de madres sanas siguieron presentando la enfermedad y a fecha del 2001 se habían dado 180.557 casos sólo en Inglaterra con un balance de 86 contagios humanos: las previsiones fallaron estrepitosamente.
Pero es que hay un caso todavía más elocuente y al que absolutamente nadie ha prestado atención: el de Suiza. Allí se prohibió alimentar en 1990 al ganado vacuno con ninguna clase de harina animal. Pese a esta medida, de las 363 vacas afectadas desde esa fecha hasta el 2001, 121 habían nacido tras la prohibición (Extraído del informe de la Organización Panamericana de la Salud del 2001). Aunque el interés de la población por el asunto ha desaparecido (llegó a ser junto al terrorismo la mayor preocupación de los españoles), no ha pasado lo mismo con los casos de enfermedad: prácticamente todos los países europeos han tenido vacas locas en sus explotaciones apareciendo cada año, sin motivo aparente y sin ninguna conexión, un goteo constante de casos aislados (salvo algunos casos de contagios masivos) hasta el reciente caso de Diciembre del 2003 de EEUU que ha hecho saltar la alarma. Al respecto de esto último Juan José Badiola, especialista español en la enfermedad, aseguró a principios de Enero en una entrevista: “Van a tener una crisis alimentaria. Usan un sistema rudimentario y aun así detectaron un caso”.
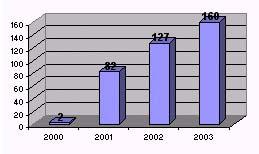
Y es que lejos de ir disminuyendo el número de casos tras la supresión de harinas, éste no para de aumentar cada año pese a las estrictas medidas de seguridad. Sólo en España se diagnosticaron 2 casos en el 2000, 82 casos en el 2001, 127 en el 2002 (fecha en la que no debería haber habido ni un solo caso por haber acabado el periodo de incubación de 5 años tras la supresión de los últimos piensos infectados) y 160 en el 2003. En la anterior entrevista, el propio Badiola da por hecho que en el 2004 serán todavía más las vacas infectadas y que la cifra seguirá en aumento durante el 2005/06.
Desde 1996 las autoridades no han reparado en gastos para vigilar el cumplimiento de la ingente cantidad de normativas impuestas: la Unión Europea ha practicado millones de diagnósticos a reses y ha creado un “taskforce” de vigilancia al tiempo que España ha creado agencias para el control de la evolución de las EET’s. Se han gastado millones de euros, se han derrochado medios y pese a ello se han dado todavía más casos. Si de verdad el único origen es el de las harinas contaminadas, ¿no debería haber mejorado la situación por poco que fuera en vez de ir cada vez a peor?.
Como se ve, el origen no puede estar tan solo en la infección con scrapie. Ciertos autores, como el del informe previamente citado, hablan de 3 medios de transmisión: la heredable, la infecciosa y la esporádica “que aparece sin causa aparente y para la que no hay explicación en la actualidad”. Además hemos visto que los priones participan en un mecanismo en el que están implicados retrovirus y retrotransposones. Por último hoy día sabemos que muchas enfermedades como cánceres están debidos a elementos genéticos que saltan y cambian de posición en el genoma debido a estrés ambiental y sobre todo psicológico. ¿Y si el estrés hubiera hecho que genes implicados en este mecanismo hubieran saltado descontroladamente alterando el buen funcionamiento de éste?, ¿Y si este estrés se debiera al hacinamiento al que están sometidas las reses? Hoy día se tiene a las vacas prácticamente inmovilizadas en minúsculos habitáculos junto a muchos cientos de congéneres que emiten una “cháchara” feromónica a la que jamás habían estado expuestas. Les administramos muy alegremente alimentos pensados nada mas que para el engorde y para el aumento de su producción de leche y además estamos alimentando a herbívoros con piensos de origen animal… No sé de que nos extrañamos al ver surgir nuevas y extrañas enfermedades en el ganado.
Una situación como esta debe estar afectando fuertemente al metabolismo celular: los elementos encargados de controlar cuándo se produce un cambio en la proteína-prión deben estar fallando, de forma que puede activarse el procedimiento de actualización ante una conformación sin sentido de la PrP, pero que en este caso no solo no tienen función biológica sino que por desgracia polimeriza en filamentos. Si estuviéramos en condiciones normales la conformación PrPsc sería rechazada, pues si no, si apareciera una sola de estas variantes por accidente (choque térmico, radiacción…) en cualquiera de nosotros, desarrollaríamos la enfermedad. En condiciones normales el organismo no aceptaría tal conformación no iniciando el cambio en cascada. Pero algo ha salido terriblemente mal: los componentes celulares que regulan este proceso han dejado de funcionar como debían debido a saltos de los elementos genéticos que los sintetizan y han iniciado el procedimiento de actualización ante una conformación que no debían como se explica en el siguiente diagrama:
Aunque esto es una especulación, creo que se trata de una muy razonable, pues de lo contrario tal y como ya he dicho, ante cualquier conformación surgida espontáneamente se iniciaría el proceso descontroladamente.
Pero, ¿cómo se ha transmitido a los humanos? Antes del salto de la enfermedad a nuestra especie, la variante humana del mal de las vacas locas era conocida como síndrome de Creutzfeldt-Jakob (CJ), una enfermedad que solo afecta a personas de avanzada edad con un cuadro de sintomatologías similar a la de vacas y otros mamíferos: demencia senil, pérdida de memoria, vacuolización del cerebro, pérdida del habla… Sin embargo la variante transmitida por la alimentación afecta a personas de cualquier edad. Otro dato interesante es que la PrPsc procedente de ovejas no hace desarrollar la enfermedad en humanos en contraposición a la de bóvidos.
Entonces, ¿qué es lo que ha pasado para que ahora los jóvenes desarrollen la enfermedad? ¿y por qué unos priones si son infecciosos y otros no? La respuesta está en que se ha visto que las PrP de humanos, ovejas y vacas son ligeramente diferentes entre sí en su secuencia de aminoácidos. Así, una célula humana al encontrarse con un prión de origen vacuno lo podría reconocer erróneamente como humano por su semejanza (aunque sea un plegamiento sin sentido) iniciando el proceso mientras que a uno de oveja no lo reconocería como propio desechándolo.
Los priones no son simples patógenos o parásitos que provocan enfermedades, no son moléculas “egoístas” que pretenden replicarse a costa de otro organismo vivo “compitiendo” con las del “huésped”. Son los partícipes de un complejo mecanismo que aporta gran dinamismo a las células, pero como en cualquier intrincada máquina, el fallo de un engranaje puede tener consecuencias desastrosas.
Ahora, una vez que estamos entendiendo qué es lo que realmente están haciendo los priones dentro de los seres vivos es cuando llegamos al aspecto realmente interesante de estas proteínas: qué significan a nivel evolutivo no solo como un mecanismo de adaptación, sino también posiblemente como un mecanismo de macroevolución (o que cuanto menos nos sirva para entender cómo funciona ésta a nivel bioquímico).
Anteriormente apuntábamos la intervención de los retrovirus durante la transmisión del cambio, pero es que la implicación de éstos va todavía mas allá. Un estudio del equipo de Jean-Luc Darlix y Caroline Gabus (2003) publicado en el Journal of Molecular Biology indicaba la asombrosa semejanza en su actuación entre el dominio-prión de la PrP y la proteína de nucleocápsida Ncp7 del virus del SIDA (VIH-1). Ambas proteínas eran capaces de plegar determinadas secuencias de DNA correspondientes precisamente a elementos transponibles, eran capaces de actuar de promotores en la síntesis de virus, inhibían en determinadas circunstancias la actuación de la transcriptasa inversa y hasta se asociaban al genoma viral de una forma semejante. ¿Qué concluyeron los investigadores? Simplemente que hay proteínas de membrana celular que pueden asociarse a DNA’s. ¿Qué es lo mas obvio que cualquiera puede deducir de este descubrimiento y que los autores por algún motivo ignoraron? Que si se parecen tanto es porque tal vez vienen del mismo lugar.
Lo que esto implica llega muy lejos pero antes merece la pena hablar de qué es lo que muy probablemente nos han traído los virus. No voy a explicarlo y razonarlo exhaustivamente porque de ello ya se ha encargado el profesor Máximo Sandín (2002 a,b), así que solo expondré la línea de razonamiento: Sabemos que las verdaderas diferencias entre unos organismos y otros no se deben precisamente por la diferencia entre sus proteínas codificantes sino a los programas embrionarios los cuales se encuentran “taquigrafiados” en el número de repeticiones de cortas de secuencias de DNA que forman el 95% del genoma (y al que los evolutistas han dado por llamar “chatarra genética” al no saber para qué sirve). Además se ha visto cómo esas repeticiones son originadas por transposones: secuencias que se duplican introduciéndose una a continuación de otra. Por último se está comprobando cómo los retrovirus al perder la capacidad de salir de la célula pueden pasar a convertirse precisamente en transposones y retrotransposones. Si mucha gente se parara a penar en ello seguro que todos concluiríamos que los programas embrionarios han sido aportados por los virus.
Pero volvamos a los priones y su a parecido con la envoltura del VIH. Esta semejanza no puede ser producto de la casualidad: de alguna forma los genes env (los que forman la cubierta viral) de nuestros virus endógenos han pasado a convertirse en los genes que sintetizan el dominio alterable de los priones y que además tiene facilidad para saltar a otros genes codificantes de proteínas para añadirles esta nueva propiedad actuando como un transposón (lo que explicaría tal vez la presencia de la desconcertante octarrepetición de la PrP de la que hablábamos en el segundo apartado). Así pues, los virus no solo nos han traído los programas embrionarios sino también un mecanismo que aporta a ciertas proteínas la capacidad de cambiar en respuesta al ambiente y de inducir el cambio de todas las demás del organismo. Ya Susan Lindquist (2000) apunta su papel en la herencia de caracteres y la posibilidad de que los dominios sean transferibles: “La presencia de módulos sugiere que […] otras proteínas podrían haber tomado estos dominios de priones y transformarse en elementos genéticos. Si lo hicieron, esta clase de patrón de herencia proteico podría haber tenido un importante efecto en el proceso de evolución”.
Pero para que se transmita el cambio que ha experimentado el individuo, la característica debe ser transmitida a la descendencia o a otros individuos. Concretamente en el caso de la PrP ya se ha demostrado su transmisión transplacentaria al feto. Si de verdad el mecanismo no estuviera mediado por el individuo esta situación no tendría sentido pues en ningún experimento se han encontrado priones fuera del sistema nervioso. ¿Cómo entonces llega al feto si no es por colaboración del afectado? La transmisión madre-hijo posibilita entonces el transmitir el carácter a la descendencia por un procedimiento que, por cierto, es lamarckiano. No veo difícil que incluso sea posible que el padre pueda transmitir su carácter a través los espermatozoides.
Pero la herencia vertical no es la única posibilidad. Si en la transmisión intervienen retrovirus para llevar nueva información a otras células, ¿qué impide a estos virus escapar del organismo y llevar la nueva proteína a otros individuos para transmitirles una propuesta? Si esto es así, creo que es totalmente factible la posibilidad de que, más que tratarse de un procedimiento que funciona a escala de individuo, estamos ante un mecanismo que opera al nivel de población.
Para entender lo siguiente recordemos lo referente a las cepas de priones: cada una tiene una conformación distinta y una vez se “escoge” una, el individuo no da marcha atrás y aunque le lleguen nuevas versiones no las acepta aunque sí las conserva hasta la aparición de un nuevo estímulo externo que las reactiva. Al producirse un cambio adverso en el medio, cada integrante busca una posible solución (en cuanto a conformaciones de sus priones se refiere) y transmite esa propuesta a sus congéneres que también han hecho lo mismo. Cada uno evalúa las propuestas y elige la que mejor se adapta a la nueva situación produciéndose un intercambio de señales que, en mi opinión, deben tener como fin “consensuar” la mejor solución y que será la que adopte toda la población y que transmitirán a los descendientes.
Pero es que las posibilidades de transferir priones horizontalmente no acaban aquí. Si se pueden transmitir a otros individuos de la especie ¿por qué no a otras especies también?. Y no estoy hablando tan solo a través de los virus. Una de las primeras propiedades que se descubrieron de los priones y que se ha visto que es común a todos los conocidos es que son proteasa-resistentes, es decir, resisten el proceso de digestión lo que tal vez (y solo tal vez) podría indicarnos que están diseñados para ello con el fin de poder transmitirse a través de las cadenas tróficas. Además resulta intrigante que los aborígenes neoguineanos tan solo contrajeran el kuru al comer ritualmente los cerebros de sus difuntos (¿no deberían entonces estar enfermos los que habían muerto?). Tal vez sea algo demasiado aventurado de pronosticar pero si fuera así, al transmitirse las propuestas de productores a consumidores, de consumidores primarios a depredadores, de todos estos a descomponedores y de nuevo al principio de la cadena alimentaria, ya no las poblaciones, sino los ecosistemas al completo tendrían una poderosísima herramienta para adaptar a todos sus integrantes con una modificación evitando que la red entera peligre al cambiar bruscamente la situación del medio.
No creo además, que todo este modo de actuación en poblaciones y ecosistemas sea exclusivo de los priones. De funcionar tal y como propongo, genes, grupos de genes y otros caracteres podrían transmitirse a través de retrovirus que ante una situación adversa capten la parte del genoma de interés y lo transmitan a los seres de su entorno produciéndose un intercambio de propuestas y respuestas al igual que antes comenté con el fin de poner en común las modificaciones que todos los individuos transmitirán a la siguiente generación. Aunque sea un modelo muy sencillo, tal vez sería la forma en que se producen los grandes cambios en las especies explicándose así el hecho de que todos los individuos cambien simultáneamente y en una misma dirección como los datos del registro fósil empiezan a demostrar.
En definitiva, los priones (y en general, todo el mecanismo asociado) son un medio de actualizar y transmitir caracteres heredables confirmándose algo que ya se sospechaba: que los genes no son los únicos elementos partícipes en la herencia y almacenaje de información, de forma que mientras los genes lo hacen en el genoma, los priones (y por qué no: también otros tipos de proteínas y factores) lo hacen a nivel de proteoma y de metaboloma alterándolos durante la vida del individuo y transmitiendo esos caracteres adquiridos vertical y horizontalmente.
Pero éstos no son cambios suficientemente grandes como para llamarles Evolución pero, ¿y si pudieran desencadenar la macroevolución en una especie?. Los grandes cambios que originan nuevas especies son debidos a reordenamientos genéticos completos de los programas embrionarios, y como hemos visto los priones poseen la capacidad de asociarse y activar elementos móviles. ¿Podrían desencadenarse los cambios bruscos en las especies por el mismo mecanismo que ya hemos explicado?, ¿podría un cambio del medio activar proteínas-prión especialmente preparadas para ello haciendo que desencadenasen reordenamientos genómicos completos?. Es muy arriesgado atribuir tantas funciones a una proteína pero dada su interactividad con el DNA, su estudio podría ayudarnos a modelizar lo que de verdad ocurre en una especie para que evolucione.
Un último apunte que quiero hacer se refiere a algo que expliqué en el apartado anterior al respecto de cómo una conformación desconocida podía confundir a los mecanismos de regulación. Tal vez sea así, o quizá podría ser que fuera correctamente reconocida, pero que por algún motivo ahora seamos más “permeables” a todo tipo de propuestas. Hemos alterado nuestro mundo y a nosotros mismos. Hemos cambiando los hábitos del ganado y nos estamos sometiendo a un estrés biológico y emocional desconocido hasta la fecha. Es por ello que tal vez estemos esperando nuevas respuestas (hablando en el ámbito de la bioquímica, por supuesto) haciéndonos receptivos ante cualquier atisbo de cambio. Los organismos atraviesan fases de exploración de alternativas y explotación de lo que ya tienen y así, ante una situación tan diferente, hemos entrado en una fase de exploración arriesgándonos a aceptar a ciegas una conformación de prión que es completamente errónea y fatal.
Los priones, como se ve, son un interesantísimo campo de estudio que hoy por hoy está poco explorado y bastante mal interpretado. Entender los priones nos ayudará a entender qué hacen los organismos para adaptarse y cambiar, y por supuesto nos ayudará a comprender qué es lo que ha fallado para que hayan aparecido las EET’s y lo que debemos hacer para evitar su aparición. También podría ayudarnos a curarlas, aunque esto último con muchísima cautela: atacar un prión es también atacar a una proteína endógena o a una una red de señalizaciones al completo de la que aún no entendemos su funcionamiento. Dados los escasísimos conocimientos que tenemos un paso en falso podría traer unas consecuencias totalmente desastrosas y sobre todo imprevisibles. No juguemos con algo que no comprendemos.
:: Brock Biología de los Microorganismos
:: Darlx, Jean-Lux, Caroline Gabus y otros. The prion protein has DNA strand transfer properties similar to retroviral nucleocapsid protein. Journal of Molecular Biology volume 307 Issue 4 (2003)
:: Deleault, Nathan R. y colaboradores. RNA molecules stimulate prion protein conversión. Nature 425, 717 – 720 (Octubre 2003)
:: Jones, Ian. “Prions shows their metal”, (http://www.chemsoc.org)
:: Lindquist, Susan L. A yeast prion provides a mechanism forgenetic variation and phenotypic diversity, Nature vol. 407, (28 Spetiembre 2000)
:: Manuelidis, Laura y Zhi Yun Lu. Virus-like interference in the latency and prevention of Creutzfeldt–Jakob disease. PANS. vol 1000. nº9 (Abril 2003)
:: Pearson, Helen. “Prions get fishy” Nature (2003)
:: Sandín, Máximo. Hacia una nueva biología. Arbor, Nº 677, pp.167-218 (2002)
:: Sandín, Máximo. Una nueva biología para una nueva sociedad. Política y Sociedad (UCM) Nº 39, pp, 537-573. (2002)
:: Sánchez Huertas, Carlos. Las enfermedades Prion o Encefalopatías Espongiformes Transmisibles (http;//www.ergonomix.com)
:: Vallat, B. La situación actual de la Encefalopatía Espongiforme Bovina (EEB) (del informe de la XII Reunión a nivel Interministerial en salud y agricultura de la Organización Panamericana de la Salud. Sao Paulo) (Mayo 2001)
Salvador Cenador
Universidad Autónoma de Madrid
http://www.uam.es/otros/geb/revista/Portada.htm



